1. ปิเปตตสารละลายไฮโดรคลอริกเข้มข้น 0.1 mol/dm3 จำนวน 25cm3ใส่ในขวดรูปกรวยขนาด 100cm3 2. หยดยูนิเวอร์ซัลอินดิเคเตอร์ 5 หยด เขย่าแล้วนำไปเปรียบเทียบสีของยูนิเวอร์ซัลอินดิเคเตอร์ในสารละลายที่มี pH ต่างๆ บันทึกค่า pH ของสารละลาย
3. ไขสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จากบิวเรตต์ลงในสารละลายข้อ 2 ครั้งละ 5cm34 ครั้ง บันทึกค่า pH ของสารละลายผสมทุกครั้งที่เติมสารละลายโซเดียมไฮดรอกไซด์ลงไป
4. เติมสารละลายโซเดียมไฮดรอกไซด์ต่อไปอีก ครั้งละ 1cm3บันทึกค่า pH ทุกครั้งที่เติม และไทเทรตต่อไปจนกระทั่งสารละลายเปลี่ยนเป็นสีม่วงน้ำเงิน วัด pH ของสารละลาย
5. หลังจากจุดยุติแล้วเติมสารละลายโซเดียมไฮดรอกไซด์ครั้งละ 1cm3ต่อไปอีก 3 ครั้ง บันทึกค่า pH
6. เขียนกราฟแสดงความสัมพันธ์ระหว่างค่า pH ของสารละลายกับปริมาตรของโซเดียมไฮดรอกไซด์ที่เติมลงไป
3. ไขสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จากบิวเรตต์ลงในสารละลายข้อ 2 ครั้งละ 5cm34 ครั้ง บันทึกค่า pH ของสารละลายผสมทุกครั้งที่เติมสารละลายโซเดียมไฮดรอกไซด์ลงไป
4. เติมสารละลายโซเดียมไฮดรอกไซด์ต่อไปอีก ครั้งละ 1cm3บันทึกค่า pH ทุกครั้งที่เติม และไทเทรตต่อไปจนกระทั่งสารละลายเปลี่ยนเป็นสีม่วงน้ำเงิน วัด pH ของสารละลาย
5. หลังจากจุดยุติแล้วเติมสารละลายโซเดียมไฮดรอกไซด์ครั้งละ 1cm3ต่อไปอีก 3 ครั้ง บันทึกค่า pH
6. เขียนกราฟแสดงความสัมพันธ์ระหว่างค่า pH ของสารละลายกับปริมาตรของโซเดียมไฮดรอกไซด์ที่เติมลงไป
ผลการทดลอง
เมื่อนำข้อมูลที่ได้จากการไทเทรตระหว่างกรด HCl กับ NaOH มาเขียนกราฟแสดงความสัมพันธ์ระหว่าง pH ของสารละลายผสม กับปริมาตรของสารละลายโซเดียมไฮดรอกไซด์ที่เติมลงไปได้กราฟดังนี้
เมื่อนำข้อมูลที่ได้จากการไทเทรตระหว่างกรด HCl กับ NaOH มาเขียนกราฟแสดงความสัมพันธ์ระหว่าง pH ของสารละลายผสม กับปริมาตรของสารละลายโซเดียมไฮดรอกไซด์ที่เติมลงไปได้กราฟดังนี้
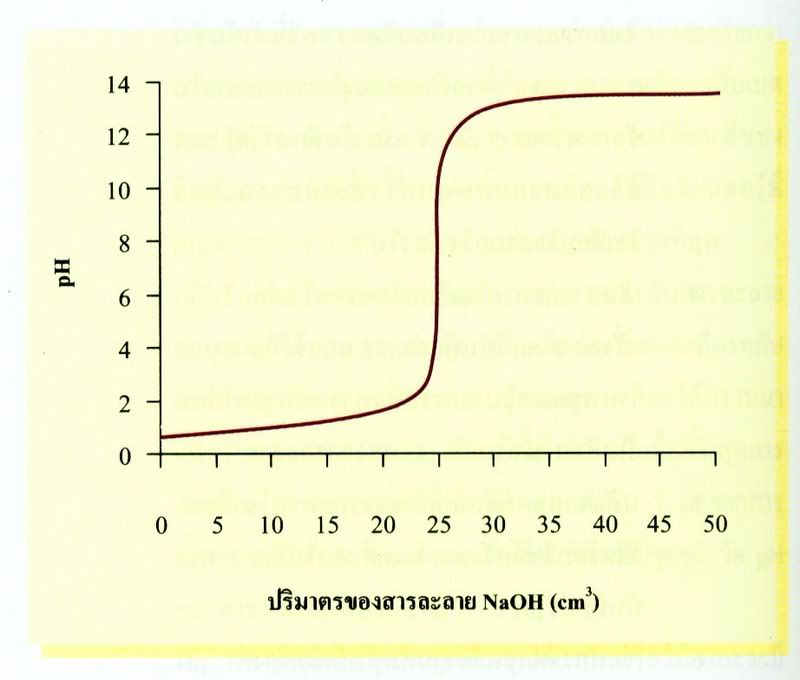
กราฟแสดงการเปลี่ยนแปลง pH ที่ได้จากการไทเทรตนี้เรียกว่า กราฟของการไทเทรต ก่อนการไทเทรตสารละลายกรดไฮโดรคลอริกเข้มข้น 0.1 mol/dm3จำนวน 25cm3ซึ่งมี
pH = 1 เมื่อไทเทรตด้วยสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จะทำให้ปริมาตรของ H3O+ในสารละลายลดลง pH ของสารละลายจะเพิ่มขึ้นเรื่อยๆ อย่างช้าๆ จนถึงจุดยุติซึ่งเป็นภาวะที่อินดิเคเตอร์เปลี่ยนสี pH ของสารละลายจะเพิ่มขึ้นอย่างรวดเร็ว กราฟช่วงนี้จะมีความชันมากที่สุด และมีช่วง pH 3-11 ณ ภาวะนี้เมื่อเติมสารละลายโวเดียมไฮดรอกไซด์ลงไปเพียงหนึ่งหยดหรือเศษส่วนของหยดเท่านั้น ก็จะทำให้อินดิเคเตอร์เปลี่ยนเป็นสีม่วงน้ำเงิน
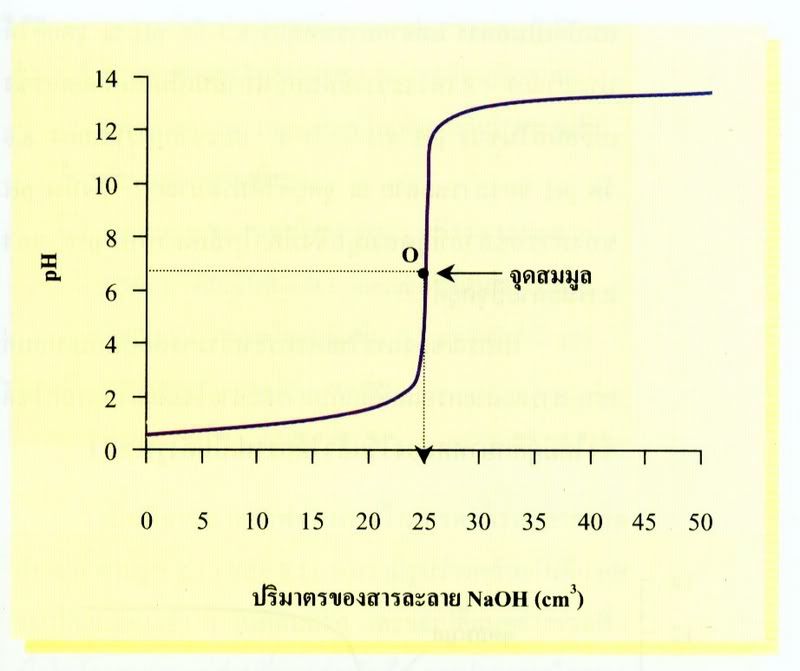
ถ้าแบ่งครึ่งเส้นกราฟส่วนที่ชันที่สุดแล้วลากเส้นจากจุดแบ่งครึ่งตั้งฉากกับแกนนอน จะตัดแกนนอนที่ 25cm3ดังรูป แสดงว่าสารละลายกรดไฮโดรคลอริกเข้มข้น 0.1 mol/dm3จำนวน 25cm3ทำปฏิกิริยาพอดีกับสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3จำนวน 25cm3ซึ่งสอดคล้องกับผลการคำนวณ จุดแบ่งครึ่งเส้นกราฟ ส่วนที่ชันที่สุดนี้คือ
จุดสมมูล ซึ่งเป็นจุดที่สารละลายโซเดียมไฮดรอกไซด์ทำปฏิกิริยาพอดีกับกรดไฮโดรคลอริก
จากจุดสมมูล ถ้าลากเส้นขนานไปกับแกนนอนไปตัดแกนตั้งจะได้ pH เท่ากับ 7 แสดงว่า pH ที่จุดสมมูลของการไทเทรตระหว่างกรดไฮโดรคลอริกกับสารละลายโซเดียมไฮดรอกไซด์มรค่าเท่ากับ 7 สารละลายผสมจึงควรมีสมบัติเป็นกลาง แต่จากการทดลองที่ 3 วัด pH จุดยุติได้ประมาณ 7-8 เพราะว่าใช้ฟีนอล์ทาลีนเป็นอินดิเคเตอร์ซึ่งเปลี่ยนสีในช่วง pH 8.3- 10.0 และจากการทดลองที่ 4 วัด pH ของสารละลาย ณ จุดยุติได้ประมาณ 7 ดังนั้น pH ของสารละลายที่จุดสมมูลจึงมีค่าใกล้เคียงกับ pH ของสารละลายที่จุดยุติ
ในกรณีของการไทเทรตระหว่างกรดอ่อนกับเบสแก่ เช่น สารละลายกรดแอซีติกกับสารละลายโซเดียมไฮดรอกไซด์ เป็นดังกราฟ
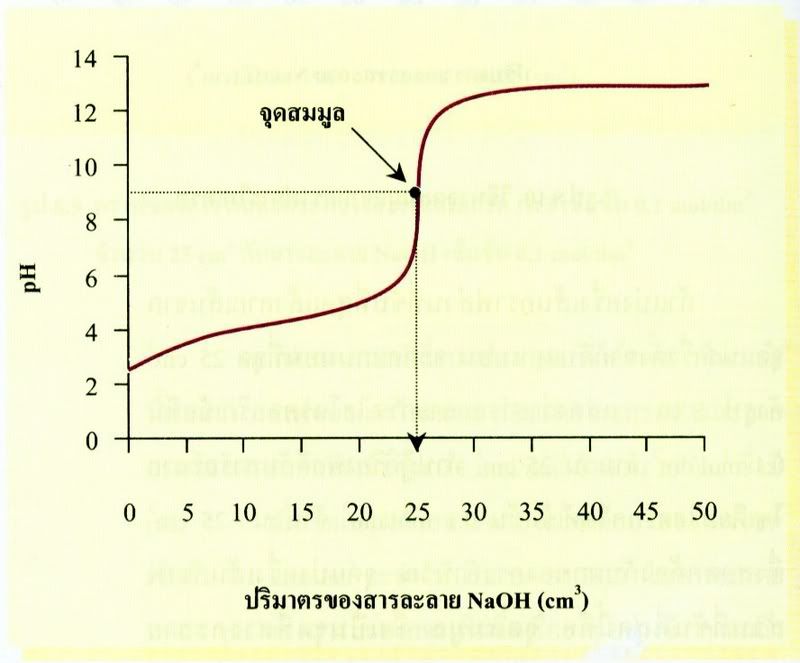
เมื่อพิจารณากราฟของการไทเทรตสารละลายกรดกับเบส ดังรูป พบว่ามีรูปร่างคล้ายกันคือ pH จะเปลี่ยนอย่างช้าๆ ในตอนแรก และจะเปลี่ยนอย่างรวดเร็วเมื่อใกล้จุดสมมูล แต่ส่วนที่แตกต่างกันคือ กราฟการไทเทรตกรดแอซิติกด้วยโซเดียมไฮดรอกไซด์มี pH ที่จุดเริ่มต้นสูงกว่า เนื่องจากกรดแอซีติกเป็นกรดอ่อน และช่วงที่กราฟมีความชันมากที่สุดสั้นกว่าคือช่วง pH 6-11 เมื่อหา pH ที่จุดสมมูลจะได้สูงกว่า 7 คือประมาณ 8.7 ทั้งนี้อธิบายได้ว่า ปฏิกิริยาระหว่างกรดแอซิติกกับโซเดียมไฮดรอกไซด์ จะได้เกลือโซเดียมแอซีเตตเกิดขึ้น
CH3COOHNa เมื่อละลายน้ำจะแตกตัวเป็นไอออนได้หมด และCH3COO-ก็จะเกิดปฏิกิริยาไฮโดรไลซิสกับน้ำต่อไปได้ OH-ดังสมการ
ดังนั้นการไทเทรตกรดแอซีติกด้วยโซเดียมไฮดรอไซด์ จึงได้สารละลายผสมมีสมบัติเป็นเบส pH ของสารละลายที่จุดสมมูลจึงมีค่ามากกว่า 7
การไทเทรตกรดอ่อนด้วยเบสอ่อน เช่น สารละลายกรดแอซีติกกับแอมโมเนีย จะได้
กราฟของการไทเทรตเป็นดังนี้
กราฟของการไทเทรตเป็นดังนี้
 จากกราฟ จะพบว่าช่วงของการเปลี่ยนแปลง pH ตรงจุดสมมูลสั้นมาก การหาจุดสมมูลจากการไทเทรตระหว่างกรดกับเบสคู่นี้ จึงค่อนข้างยากและไม่เที่ยงตรง ดังนั้นในทางปฏิบัติจึงไม่นิยมการไทเทรตระหว่างกรดอ่อนกับเบสอ่อน
จากกราฟ จะพบว่าช่วงของการเปลี่ยนแปลง pH ตรงจุดสมมูลสั้นมาก การหาจุดสมมูลจากการไทเทรตระหว่างกรดกับเบสคู่นี้ จึงค่อนข้างยากและไม่เที่ยงตรง ดังนั้นในทางปฏิบัติจึงไม่นิยมการไทเทรตระหว่างกรดอ่อนกับเบสอ่อน ในการไทเทรตระหว่างกรดกับเบส สิ่งที่สำคัญที่ต้องการทราบก็คือ จุดที่กรดกับเบสทำปฏิกิริยาพอดีกันหรือจุดสมมูล ซึ่งจะหาได้โดยใช้อินดิเคเตอร์ช่วยบอกจุดยุติของการไทเทรต ดังนั้นจึงต้องเลือกใช้อินดิเคเตอร์ให้เหมาะสม เพื่อให้ pH ที่จุดยุติใกล้เคียงกับ pH ของจุดสมมูลมากที่สุด


ไม่มีความคิดเห็น:
แสดงความคิดเห็น